50.00mL de NaOH 0.1M y agregamos HCl 0.1M
Calculo del volumen necesario de HCl para neutralizar toda el NaOH
N*V de NaOH = NV de HCl
(0.1)*(50)=(0.1)*V de HCl VHCl =50ml osea cuando agregue los 50ml de HCl el pH=7
50ml de HCl es nuestro volumen de equivalencia ¿qué signica esto?
a) Si añadimos volúmenes de HCl menores a 50mL, todo el HCL se consumirá con el NaOH, quedando parte del NaOH sin reaccionar que es que nos da los iones hidróxilo (OH-) según la reacción: NaOH ---> Na+ + OH- lo cual debería darnos un pH básico (mayor que 7).
Adición de 0.0mL de HCl 0.1M (inicialmente solo hay NaOH)
NaOH ---> Na+ + OH-
Iniciales 0.1M 0 0
Reaccionan 0.1M 0 0
Forman 0 0.1M 0.1M
_______________________________________
Equilibrio (0.1-0.1) 0.1M 0.1M entonces [OH-]=0.1M pOH=-Log[OH-]
pOH = - Log[0.1] = 1 pH=14 - pOH pH = 14 - 1 pH=13
Adición de 5.00mL de HCl 0.1M (todo el HCl reacciona o se consume)
Reacción de Neutralización
NaOH + HCl --------> NaCl + H2O
Moles Iniciales 0.1(50)=5mmol 0.1(5)=0.5 0 0
Moles Reaccionan 0.5 0.5 0 0
Moles que se forman 0 0 0.5 0.5
------------------------------------------------------------------------------------------------------------------
Moles en Equilibrio 5 - 0.5 = 4.5mmol 0.5-0.5=0 0.5 0.5
El nuevo Volumen de la solución serán los 50mL de NaOH + 5mL de HCl añadidos
Vsol = 55mL como ya vimos al inicio [NaOH] = [OH-]
[NaOH] = 4.5mmol/55mL = 4.5mol/55L = 0.081818181 [OH-] = 0.081818181
pOH=-Log[OH-] pOH = - Log[0.0818118] = 1.08715018 pH=14 - pOH pH = 14 - 1.08715018
pH=12.91
Análogamente se obtienen los siguientes valores para volúmenes menores a 50mL
VHCl añadido pH
15 12.73
25 12.52
40 12.05
45 11.72
49 11.00
b) Si añadimos volúmenes de HCl mayores a 50mL, se consumirá todos lo 50 mLde NaOH, quedando en exceso HCl sin reaccionar que es que nos da los iones hidrónio (H3O+) oque también se le conoce como H+, según la reacción:
HCl ---> H+ + Cl- lo cual debería darnos un pH ácido (menor que 7).
Adición de 51.0 mL de HCl 0.1M (HCl en exceso)
Reacción de Neutralización
NaOH + HCl --------> NaCl + H2O
Moles Iniciales 0.1(50)=5mmol 0.1(51)=5.1mmol 0 0
Moles Reaccionan 5 5 0 0
Moles que se forman 0 0 5 5
---------------------------------------------------------------------------------------------------------------------------------
Moles en Equilibrio 5 - 5 = 0.0 mmol 5.1-5=0.1 5 5
El nuevo Volumen de la solución serán los 50mL de NaOH + 51mL de HCl añadidos
Vsol = 101mL
En el equilibrio no queda nada de NaOH, pero quedan 0.1mmoles de HCl el cual se disocia según: HCl ----> H+ + Cl- o sea [HCl] = [H+]
[HCl] = 0.1mmol/101mL = 0.1mol/101L = 0.0009901 [H+] = 0.0009901
pH=-Log[H+] pH = - Log[0.0009901] ---> pH = 3.00
Análogamente se obtienen los siguientes valores para volúmenes mayores a 50mL
VHCl añadido pH
55 2.32
60 2.04
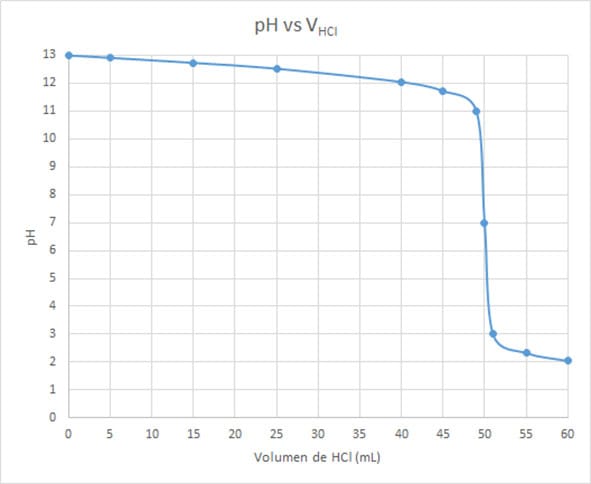
Gráfica de pH vs VHCl
VHCl añadido pH
0 13,00
5 12.91
15 12.73
25 12.52
40 12.05
45 11.72
49 11.00
50 7.00
51 3.00
55 2.32
60 2.04