Quimica: moles de soluto y litros de disolución
Algún experto en química que me pueda auxiliar en este tema en calculo de moles, es para bachillerato gracias.
Problema 1.
Calcula ¿cuál es la concentración molar de una solución que se prepara disolviendo 85 gramos de NaCl en agua hasta formar 1.5 litros de disolución?
Nota: redondea a números enteros las masas atómicas de los elementos.
- Datos:
- NaCl = 85 g
- Volumen de la solución 1.5 l
- Fórmulas:
- a) n = g de soluto / masa molecular
- b) m = n / l de solución
Recuerda: La masa molecular es la suma de las masas atómicas de los elementos que forman el compuesto.
Utiliza la fórmula a para calcular el número de moles, sustituye los valores y efectúa las operaciones correspondientes.
- a) N = g de soluto / masa molecular
Con el número de moles calculado, utiliza la fórmula b, sustituye los datos y efectúa las operaciones correspondientes.
- b) Molaridad = n/l de solución
- Resultado:
- Explica brevemente tu respuesta, indicando por qué te dio ese resultado y qué significa.
Problema 2.
Calcula ¿cuál es la concentración molar de una solución que se prepara disolviendo 70 gramos de NaOH en agua hasta formar 2.5 litros de disolución?
Nota: redondea a números enteros las masas atómicas de los elementos.
- Datos:
- NaOH = 70 g
- Volumen de la solución 2.5 l
- Fórmulas:
- a) n = g de soluto / masa molecular
- b) m = n / l de solución
Recuerda: La masa molecular es la suma de las masas atómicas de los elementos que forman el compuesto.
Utiliza la fórmula a para calcular el número de moles, sustituye los valores y efectúa las operaciones correspondientes.
- a) N = g de soluto / masa molecular
Con el número de moles calculado, utiliza la fórmula b, sustituye los datos y efectúa las operaciones correspondientes.
- b) Molaridad = n/l de solución
- Resultado:
- Explica brevemente tu respuesta, indicando por qué te dio ese resultado y qué significa.
Recuerda:
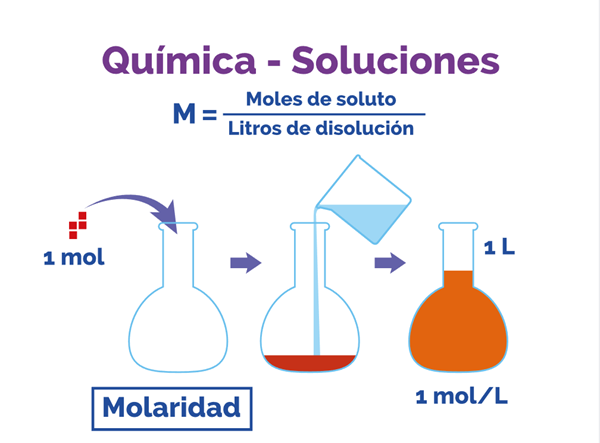
Las disoluciones cuantitativas o valoradas (%, M, N, ppm y fracción molar), consideran la proporción numérica que existe entre el soluto o del disolvente. Mide la concentración de la disolución, que se define como la cantidad de soluto disuelta en una cierta cantidad de disolvente.
Para calcular el número de moles es necesario utilizar la fórmula:
n = a / PM
Donde:
n = Número de moles
a = Gramos de la sustancia
PM = Peso molecular (masa molecular)
Para sacar el peso molecular es necesario que recurras a la Tabla periódica, y obtengas el peso de cada uno de los elementos involucrados.
El mol (molécula gramo) es una Unidad Internacional usada para medir la cantidad de una sustancia.
Un mol de una sustancia expresado en g es su masa molecular.
La Molaridad se representa con M mayúscula, para no confundir con Molalidad = (moles/Kg de solución) que se representa con m minúscula

albert buscapolos Ing° Gracias Prof nos sirve de ayuda opino lo mismo que Antonia - Móni Bonilla
albert buscapolos Ing° Solo podrá decirme como obtuvo el resultado ? Por favor... - Móni Bonilla
Disculpa y si hay que calcular el número de mol de soluto? Como ejemplo: 2.5l de BaCL2 (cloruro de bario), 2.0 M - Melissa Gonzales