La especie oxidante es la que se reduce, es decir la que disminuye su estado de oxidación, es el Mn del KMnO4, pues:
El estado de oxidaciónen del Mn en KMnO4 en reactivos es +7, +1(K)+X(Mn)-4x2 (O)=0, X=+7
El estado de oxidaciónen del Mn en MnCl2 en productos es +2, X (Mn)- 2 = 0, x=+2
La especie reductora es la que se oxida, es decir la que aumenta su estado de oxidación, es el Cl del HCl, pues:
El estado de oxidaciónen del Cl en HClen reactivos es -1, +1(H)+X(Cl) = 0, X=-1
El estado de oxidaciónen del Cl en Cl2 en productos es 0, es lamolécula de un elemento.
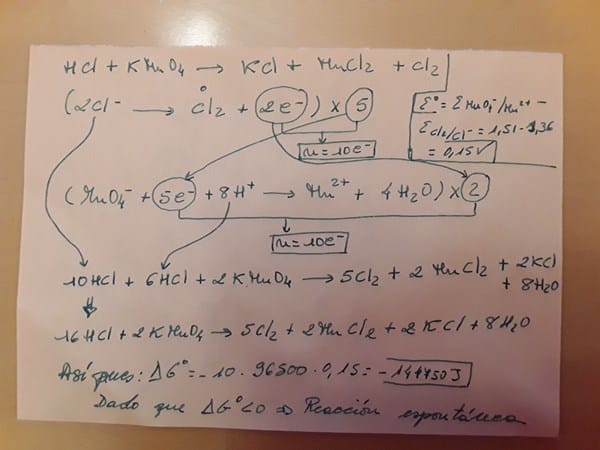
Aplicando la ecuación de la energía libre de Gibbs: ΔGº=-n·F·Eº,
Siendo n el número de electrones intercambiados, F es la constante de Faraday, 96500 J/V·mol, y Eº la fuerza electromotriz normal.
Para aplicar la ecuación hay que igualar la reacción... mejor lo hago en un papel:
Espero que te sea de utilidad, si tienes dudas, contacta conmigo, sin problemas.
Por favor, si te parece bien valora mi respuesta
PXC

