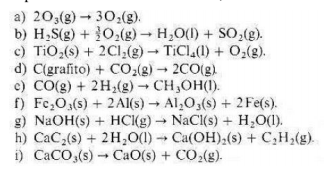Como no das acceso a la tabla A-V sólo puedo indicarte lo que tienes que hacer.
Supongo que esa tabla da las entalpías de formación de diferentes sustancias.
Conociendo las entalpías de formación se puede calcular la entalpía de cualquier reacción de la siguiente forma:
Sumas las entalpías de formación de los productos de la reacción multiplicadas por sus respectivos coeficientes estequiométricos y a esa suma le restas la suma de las entalpías de formación de los reactivos multiplicadas por sus respectivos coeficientes estequiométricos. Esa diferencia es la entalpía de la reacción.
Hay que tener en cuenta que la entalpía de formación de cualquier elemento en su forma más estable en condiciones estándar (1 atm y 298 K) es cero. Así, la entalpía de formación del O2 es 0, pero no así la del O3, que vale 142,5 KJ/mol.
Por ejemplo, la entalpía de la primera reacción es
$$\begin{align}&\Delta H_r^0=3·\Delta H_{f(O2)}^0-2·\Delta H_{f(O_3)}^0=3·0-2·142,5=-285\ KJ/mol\end{align}$$