En realidad el electrón NO GIRA alrededor del núcleo.
Hagamos un poco de historia: Los primitivos modelos atómicos, como el
de Dalton y el de Thompson, eran directamente BASURA. No servían para
nada. Después aparece el de Rutherford, donde pone como estas diciendo
"los electrones girando alrededor del núcleo", pero Rutherford los
Suponía casi como "formando una pelota", todos en órbitas lejanas,
confusas y entremezcladas.
Finalmente aparece Bohr, con su "Modelo atómico", donde calcula hasta
los radios de giro de los electrones, y la distribución por capas y la
cantidad de electrones por capas: Ese funciono RELATIVAMENTE BIEN... o
digamos "Bien para el átomo de Hidrógeno y de regular a mal para el
resto de los átomos".
Vale lo de "los electrones por capas"... pero NO VALE lo de las
"Órbitas circulares".
Curiosamente, UN SIGLO después que sabemos que el "Átomo de Bohr" es
INCORRECTO... se sigue enseñando en las escuelas como si fuese "Verdad
santa"!.
¿Por qué se sigue enseñando eso?. Creo que "porque es una forma fácil de
hacerle entender el átomo a un estudiante". Pero resulta que cuando
ese estudiante llega a algo más avanzado... se encuentra que lo que le
enseñaron sobre al átomo no sirve para casi nada!.
El cambio lo trae la CUÁNTICA: Que nos dice un par de cosas:
-Los electrones pueden tener en el átomo solo ciertos NIVELES DE
ENERGÍA DETERMINADOS, a los que llamamos "Orbitales": O sea que la
Energía de un electrón es discreta: puede valer un valor, o múltiplos
De ese valor... pero nunca los valores intermedios: O sea que cuando un
Electrón pasa de un nivel al siguiente, es como si "se desvaneciera de
uno para reaparecer en el otro"... Nadie los puede detectar "a mitad de
camino"!
- El Principio de Incertidumbre nos demuestra que es imposible conocer
"Velocidad y intentar de una partícula al mismo tiempo"... y si
realmente girase en una órbita circular, podríamos determinarla!
Así que, los electrones están alrededor del núcleo en ZONAS DE
PROBABILIDAD que se llaman ORBITALES... pero, salvo en el caso del más
Bajo, el Orbital 1S (que coincide con el átomo de Bohr para el
Hidrógeno!), los demás ni siquiera son esféricos... sino que esas
"zonas de probabilidad" tienen forma como de peras alargadas, tal como este:
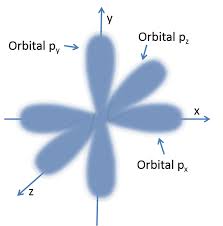
Resumiendo:
-El electrón NO GIRA alrededor del núcleo
-El electrón permanece dentro de "Zonas de probabilidad" que se llaman
ORBITALES, y los hay de varios tipos (S, P, SP, etc...)
-El electrón no puede estar NUNCA fuera de esa zona, pero tampoco es
posible saber "en que lugar de esa zona" se encuentra en determinado
momento.
-Esto como anexo... el electrón NO PUEDE caer NUNCA AL NÚCLEO (La
Explicación para eso es bastante compleja así que lo vas a tener que
creer, al menos de momento). Mientras que en ese modelo que "El
Electrón gira tipo mini-sistema solar", el electrón, tal como dice al
principio, iría perdiendo energía... y terminaría cayendo al núcleo.
...
POSDATA: Esto es repetido de lo que te mande al mail, ja ja!


Hermosa descripcion en sucesion historica hace Boris, y solo agregaria que la imposibilidad de determinar el lugar exacto del electron dentro de las zonas de probabilidad es una de las consecuencias del llamado " Principio de Incertidumbre" enunciado por Werner Heisemberg ( Nobel de Fisica 1932). - albert buscapolos Ing°
Está muy bien explicado y no hay ninguna vergüenza en preguntar sobre esto! Lo único que advierto un gazapo en la frase "Velocidad y intentar de una partícula al mismo tiempo" cuando quiso decir "Velocidad y posición de una partícula al mismo tiempo". Y añado que sí se puede saber su posición aproximada, pero cuanto más preciso sea determinar una de las variables, más errónea será la otra. Esto significa que la precisión para medir posición/velocidad es limitada y viene definida por la constante de Planck - Segytel SL
Gracias por la correccion Segytel!. Mi defensa es que fue culpa del "Corrector ortografico". Ya es la segunda vez que me pasa, que me cambia una palabra por otra...y me cambia el sentido de la respuesta. La primera vez me di cuenta y lo corregi....esta se me paso por alto (estaba con una tarea importantisima: Cocinandome la cena!) - Boris Berkov
Está usted completamente exonerado de cualquier culpa.La cena, que es no es un "principio de incertidumbre" sino un "fin (del día) cierto", es mucho más importante!! je je je.Un saludo y le agradecemos todos su magnífico aporte. - Segytel SL