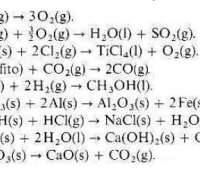Respuesta
en
Química
y en 3 temas más
a
Entalpía usando tabla. A partir de los datos de la tabla A-V, calcule los valores deΔH0-298K para las reacciones siguientes:
Respuesta
en
Química
y en 1 temas más
a
¿Por qué en algunos ácidos se simplifica los números y en otros no?
Siempre que se puede, se simplifica. Pero en el H2SO4 no se puede; lo que has hecho no está bien, pues divides entre 2 sólo dos de los tres elementos que tiene la fórmula. Simplificar implica dividir TODOS los elementos por el mismo número.
Respuesta
en
Química
y en 3 temas más
a
Balancear esta ecuacion por el metodo redox y metodo ion-electron Zn + HNO3 NO2 + Zn(NO3)2 + H2O
Ion-electrón Escribiremos como iones las sustancias que forman o pueden formar iones. Oxidante: NO3(-). El nº de oxid. Del N pasa de +5 en el NO3- a +4 en el NO2 (se reduce) Reductor: Zn. El nº de oxid. Del Zn pasa de 0 a +2 (se oxida) Para ajustar...
Respuesta
en
Química
y en 2 temas más
a
¿Como puedo resolver la siguiente reacción?
a) Lo primero es ajustar la reacción por el método del ion-electrón en medio básico: 6 KOH + 3 Cl2 ----> KClO3 + 5 KCl + 3 H2O Ahora calculamos el número de moles de cada reactivo: n(KOH) = 10 g / 56g/mol = 0,179 mol KOH n(Cl2) = 10 g / 71 g/mol =...
Respuesta
en
Química
y en 1 temas más
a
¿Qué masa de KNO3 de 10 Kg se solución acuosa saturada?
Si llamamos x a la masa en g de soluto en 10000 g de solución a 80 ºC, la masa de agua de esta solución vale (10000 - x) g. Entonces, Si en 100 g de agua se disuelven 169 g de KNO3 En (10000 - x) g de agua se disolverán x g de KNO3: x = 169 · (10000...
Respuesta
en
Química
y en 2 temas más
a
Solución resultante es Ácida, ¿Neutra o Alcalina?
Moles de NaOH = 0,250 L · 0,05 mol/L = 1,25 · 10^(-2) mol NaOH Moles de H2SO4 = 0,300 L · 0,03 mol/L = 9 · 10^3 mol H2SO4 La reacción entre ellos es H2SO4 + 2 NaOH ----> Na2SO4 + 2 H2O Cada dos moles de NaOH reaccionan exactamente con un mol de...
Respuesta
en
Química
y en 2 temas más
a
¿Cuántos Moles de ácido o base quedan sin reaccionar? ¿Y cuál es el Ph resultante?
En primer lugar calcularemos los moles de ambos reactivos. HCl: Si esta solución tiene pH = 2, la concentración de H(+) es [H+] = antilog (-2,4) = 3,98 ·10^(-3) mol/L Como el HCl está completamente disociado, y cada mol de HCl origina un mol de H(+),...
Respuesta
en
Química
y en 4 temas más
a
Solución hallar el dióxido de azufre
Respuesta
en
Química
y en 1 temas más
a
¿Cuál es la proporción en masa en qué deben reaccionar el carbono y el oxígeno, respectivamente, para formar dióxido de carbono?
Masa molecular del CO2 = 12 + 2·16 = 44 De las 44 unidades, 12 son de C y 32 de O, luego la relación en la que se combinan estos elementos para dar CO2 es 12/32 = 3/8. Por tanto, Si 3 g de carbono se combinan con 8 g de oxígeno 36 g de carbono se...
Respuesta
en
Química
y en 3 temas más
a